葡萄糖和谷氨酰胺是支持細胞中能量產生和生物合成的兩種營養物質。其中谷氨酰胺不僅提供碳,還提供氮,是合成各種化合物(如嘌呤和嘧啶核苷酸、氨基葡萄糖6-磷酸和非必需氨基酸)所必需的。谷氨酰胺也是癌癥細胞生物能量和生物合成所需的重要碳源。雖然谷氨酰胺分別與谷氨酰胺酶(GLS1)和5-磷酸核糖焦磷酸(PPAT)直接發生分解代謝和合成代謝反應,但谷氨酰胺與腫瘤惡性程度之間的關系仍未完全闡明。為了解谷氨酰胺與腫瘤之間的關系,日本九州大學Keiichi I. Nakayama團隊利用靶向蛋白質組學(iMPAQT)與代謝組學分析結合穩定同位素標記谷氨酰胺檢測小細胞肺癌(SCLC)等癌癥代謝全貌,相關成果發表于《Nature Communications》。
蛋白質組和代謝組學變化的整體視角
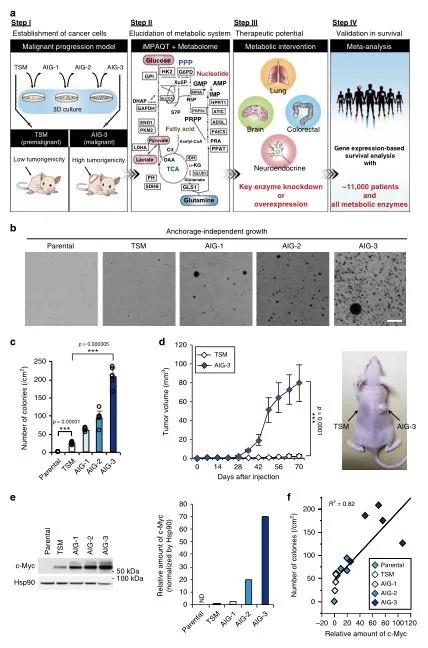
這項研究的概況如圖1a所示。為了用iMPAQT系統描述癌癥惡性進展過程中代謝變化的整體情況,研究團隊首先建立了一個惡性轉化模型,用編碼人端粒酶催化成分(hTERT)和c-Myc的逆轉錄病毒感染正常人二倍體成纖維細胞(TIG-3),將在三維(3-D)培養基中生長的TSM克隆在2-D培養基中擴增以獲得AIG(錨定非依賴性生長)-1、AIG-2和AIG-3細胞,TSM到AIG-3的惡性進展與c-Myc表達增加有關(圖1e-f)。
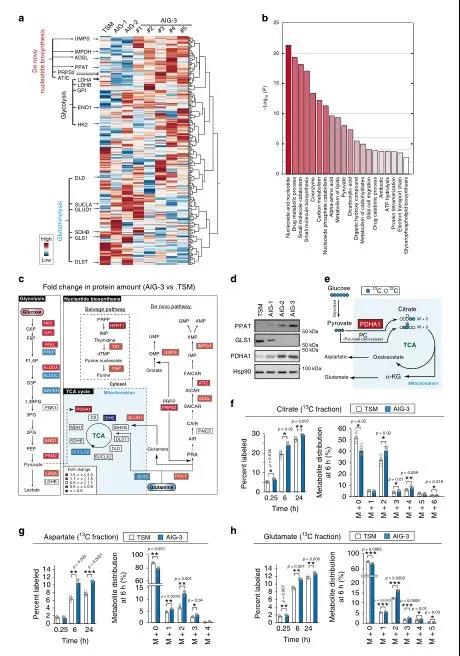
將iMPAQT系統應用于TSM以及AIG-1、-2和-3克隆,以綜合測定342種代謝酶的豐度。與TSM細胞相比,AIG-3細胞中某些糖酵解酶的數量增加,包括己糖激酶2(HK2)、烯醇化酶1(ENO1)和乳酸脫氫酶A(LDHA),葡萄糖攝取量也增加(圖2a)。這些結果表明,Warburg效應在AIG-3細胞中比在TSM細胞中更為明顯。基因本體(GO)富集分析表明,與TSM細胞相比,AIG-3細胞中受影響最大的生物學過程是核酸生物合成。因此,與TSM細胞相比,AIG-3細胞中核苷酸生物合成途徑(從頭合成和回補途徑)中的大多數酶,包括代謝谷氨酰胺的PPAT的含量都協同增加,而谷氨酰胺逆轉途徑的限速酶GLS1的表達在AIG-3細胞中下調(圖2c,d)。為了證實在蛋白質組水平上觀察到的這些葡萄糖代謝的變化,用
[13C6]葡萄糖(圖2e)進行了大量的
同位素分析,發現AIG-3細胞的13C標記效率和檸檬酸、天冬氨酸和谷氨酸的代謝物池大小都明顯高于TSM細胞(圖2f-h)。
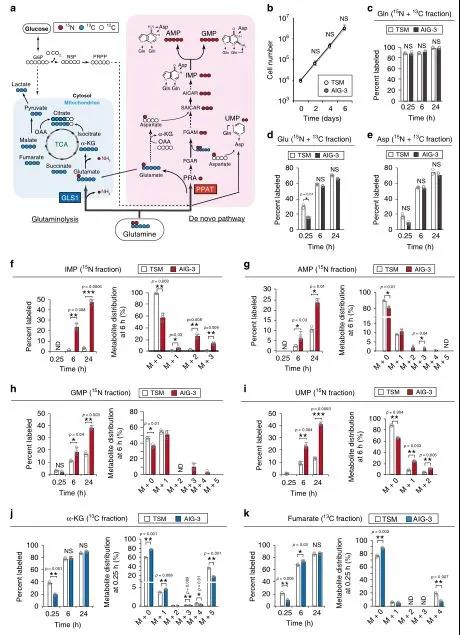
為了證實在蛋白質組水平上觀察到的谷氨酰胺代謝的變化,用[13C5/15N2]谷氨酰胺以及TSM和AIG-3細胞進行了大量的同位素分析(圖3a),隨后評估了每個反應在標記開始后的早期(0.25小時)和后期(6小時和24小時)的標記效率。雖然在TSM或AIG-3細胞中沒有檢測到IMP、AMP、GMP或UMP的13C組分,但在標記開始后的6和24小時,AIG-3細胞中15N進入核苷酸生物合成途徑的IMP(圖3f)、AMP(圖3g)、GMP(圖3h)和UMP(圖3i)的摻入量都顯著高于TSM細胞。在AIG-3細胞中,IMP對氮的標記效率不僅在M+1和M+2組分增加,而且在M+3組分也有同樣效果(圖3f),這表明來自[15N]谷氨酰胺的
[15N]天冬氨酸也參與了這種標記(圖3e)。
在含有人體血漿生理濃度氨基酸的培養基中培養5天后,用0.6 mM [13C5/15N2]谷氨酰胺標記TSM和AIG-3細胞,AIG-3細胞對AMP和GMP的15N標記效率顯著高于TSM細胞。在標記后0.25h基本上未檢測到15N核酸代謝物,這表明在早期由GLS1介導的谷氨酰胺回補反應主要負責α-KG和富馬酸的產生。標記6h或24h后兩種細胞中α-KG和富馬酸鹽的13C標記效率沒有差異(圖3j-k),表明在該時間點這些代謝物反映了源自GLS1和PPAT依賴途徑的總和。與TSM細胞相比,AIG-3細胞在0.25h時α-KG和富馬酸標記效率顯著降低(圖3j-k),表明AIG-3細胞中GLS1活性降低。綜上,蛋白質組學和代謝組學數據一致表明,在實驗癌細胞模型惡性轉化過程中,谷氨酰胺的命運基本上從TCA循環轉移到核苷酸生物合成途徑。
PPAT-GLS1平衡決定谷氨酰胺的命運
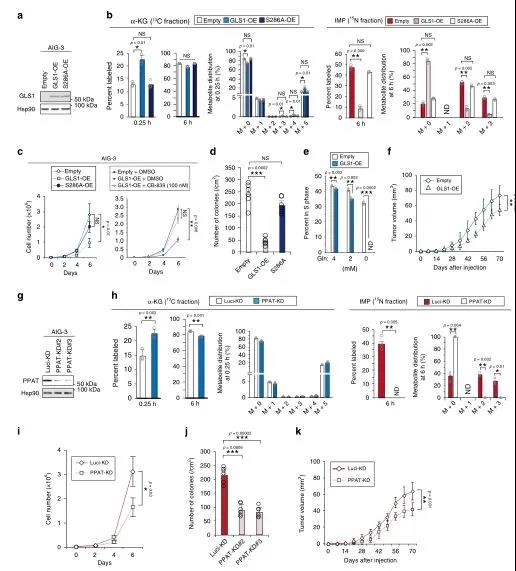
在惡性轉化過程中,PPAT和GLS1的表達分別升高和降低,導致PPAT/GLS1比值升高。為了研究這兩種酶之間的平衡對細胞增殖是否具有確定性,研究了GLS1在AIG-3細胞中過表達的影響(圖4a)。以缺乏酶活性的突變型(S286A)的GLS1作為對照,在[13C5/15N2]中,強制表達GLS1導致α-KG標記率增加,而IMP(圖4b)、AMP、GMP、谷氨酸和天冬氨酸標記率降低。AIG-3細胞在2-D(圖4c)或3-D(圖4d)培養基中的增殖速率也由于GLS1過表達而顯著降低。且用GLS1抑制劑CB-839處理可逆轉GLS1過表達并抑制AIG-3細胞增殖(圖4c)。總的來說,GLS1的過度活化會抑制腫瘤生長。另外,分析了短發夾RNA(shRNA)介導的RNA干擾對AIG-3細胞PPAT耗竭的影響(圖4g),通過實驗證明PPAT活性降低會抑制腫瘤生長,GLS1和PPAT之間的平衡控制著谷氨酰胺衍生的碳和氮代謝從而調控細胞增殖和腫瘤生長。
PPAT作為治療小細胞肺癌的新靶點
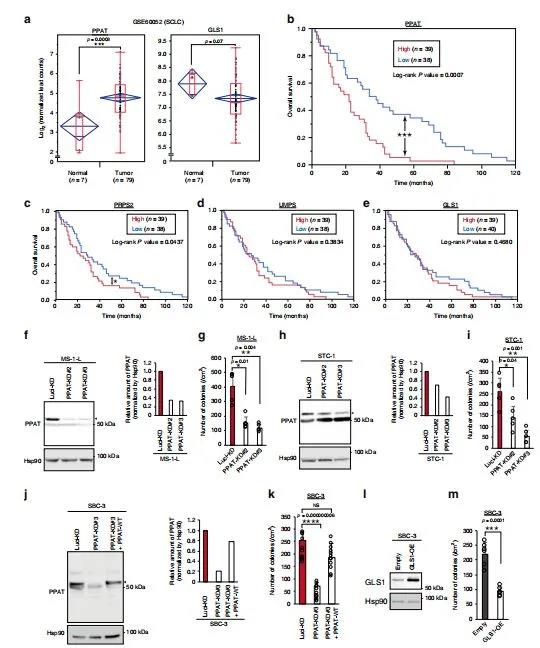
通過觀察發現PPAT的表達與神經內分泌癌的不良預后顯著相關,因此研究調查了這種表達是否也與小細胞肺癌(SCLC)的預后有關。小細胞肺癌患者的RNA測序數據顯示,PPAT在腫瘤中的表達高于正常組織,而GLS1在腫瘤中的表達低于正常組織(圖5a),PPAT高表達的個體的預后明顯差于低表達的個體(圖5b),作為嘧啶合成限速酶的UMP合成酶(UMPS)(圖5d)和GLS1(圖5e)的表達似乎都與小細胞肺癌患者的預后無關。
PPAT的缺失抑制了所有三種細胞系的錨定依賴性生長(圖5f-k),而在SBC-3細胞中,這種作用被PPAT以一種抵抗shRNA介導的擊倒的方式強制表達而逆轉(圖5j,k)。GLS1的過表達也抑制了SBC-3細胞的非錨定生長(圖5l,m)。總之,PPAT的表達與小細胞肺癌患者的不良預后密切相關,并且PPAT的缺失抑制了SCLC細胞系的貼壁性生長,揭示PPAT可能是小細胞肺癌的一個有前途的治療靶點。
該研究確定了控制谷氨酰胺代謝命運的關鍵因素,以及不同器官腫瘤對這些因素的依賴性。該發現為探索不同的癌癥治療方案提供了基礎。
文章來源:網絡
 中國特種氣體供應首選品牌
中國特種氣體供應首選品牌